El mal de Chagas: una perspectiva histórica y la urgencia de financiar las vacunas para lucharlo
by David Burke, Romance Languages
Chagas disease is a parasitic illness endemic to Latin America and the southern United States. Discovered in 1909 in Brazil by Dr. Carlos Chagas, it now encompasses much of the Western Hemisphere. After initial infection, the parasite can lie dormant for decades, and in thirty percent of cases, chronic complications like cardiomyopathy develop, leading to an ultimate mortality rate of around 2.3%. Six to eight million people are infected worldwide, of which ten thousand die yearly. The disease’s annual financial burden is seven billion US dollars in premature deaths, medical care, and lost productivity. Spread by triatomine insects, colloquially called “kissing bugs” for their propensity to bite, the disease ravages poorer areas with lower quality sanitation and construction. Thus, Chagas is considered a poor person’s disease. Due to this reputation, there is little financial incentive for governments or pharmaceutical companies to prioritize better treatments or a cure. In fact, between 2008 and 2013, only six million dollars were allocated to vaccine production despite the seven-billion-dollar annual financial burden. Current antiparasitic treatments are relatively effective, but only when Chagas is detected early, which is rare due to the high costs and limited availability of surveillance tests. Moreover, these drugs cause many adverse side effects. Investigators face the challenge of constructing a vaccine against a parasitic disease, a class of diseases for which only one successful and highly novel vaccine has been produced in the case of malaria. Nevertheless, university researchers in the United States, Argentina, Brazil, and Spain aim to create a Chagas vaccine with funding from public nonprofits. Although slow, the results are increasingly promising. World governments, pharmaceutical companies, and public health organizations must prioritize allocating resources to vaccine efforts to save thousands of lives and billions of dollars annually.
Introducción
El mal de Chagas es una enfermedad parasitaria causada por Trypanosoma cruzi que afecta a millones de personas en América Central, América del Sur y Estados Unidos. La enfermedad causa complicaciones crónicas en los tejidos cardíacos y digestivos y mata a diez mil personas cada año (“La enfermedad de Chagas”). Además, el gasto económico anual de la enfermedad es de más de siete mil millones de dólares estadounidenses por la atención médica y la productividad perdida (Beaumier et al. 2996). Se descubrió a principios del siglo XX y, desde entonces, ha habido resistencia, confusión y a día de hoy, por una falta de apoyo e incentivos financieros, una pura apatía hacia los esfuerzos de curarlo.
Los tratamientos farmacéuticos actuales contra el Chagas son de eficacia limitada y no se pueden usar en casos asintomáticos por sus efectos secundarios negativos. Además, solo funcionan durante las etapas tempranas de la enfermedad y no para los casos crónicos (“CDC – Chagas Disease”). A pesar de los defectos de los tratamientos quimioterapéuticos, las compañías farmacéuticas y los gobiernos de la región no priorizan la búsqueda de mejores tratamientos ni métodos de prevención porque el Chagas se considera una enfermedad de pobres. Sin embargo, hay investigadores de universidades en Estados Unidos, Argentina, Brasil y España que buscan curarlo con resultados prometedores, aunque lentos, en las pruebas iniciales. Estos investigadores reciben ayuda de organizaciones sin ánimo de lucro y del sector público para desarrollar las vacunas (Dumonteil et al. 1). Este ensayo demostrará que, aunque es difícil de prevenir y tratar, curar el Chagas no es imposible, como han demostrado estos esfuerzos. Aunque los tratamientos actuales no son perfectos, son el primer paso en el camino hacia el mejor control de la enfermedad. En el futuro, es esencial que los gobiernos del mundo y las organizaciones de salud pública aporten más recursos para facilitar el desarrollo de las vacunas contra el Chagas para salvar miles de vidas y ahorrar miles de millones de dólares al año.

Figure 1. Carlos Chagas, el científico consumado que descubrió el mal de Chagas en 1909. Photo by J. Pinto, Public Domain via Wikimedia Commons
La historia de la enfermedad
En 1908, mientras Carlos Chagas, un médico brasileño de treinta años, lideraba una campaña contra la malaria en Minas Gerais, Brasil (Lewinsohn 533), recibió informes de un desarrollo preocupante. En muchos trabajadores locales, las picaduras de insectos estaban causando un brote de casos de una enfermedad desconocida. La enfermedad causaba hinchazones en el lugar de la picadura, más frecuentemente la cara, y se asociaba con otros síntomas también, como fiebre, fatiga, dolor de la cabeza y malestar general. Al comienzo, no estaba claro si esta enfermedad era la malaria, transmitida por un vector nuevo, o si era una enfermedad totalmente nueva (Náquira y Cabrera 495). En realidad, a pesar de las semejanzas con la malaria, el culpable era un parásito anteriormente desconocido.
El misterio se resolvió el 14 de abril 1909 cuando Chagas cuidó a una niña de dos años que presentaba síntomas de malaria. Tomó una muestra sanguínea y al examinarla, descubrió un parásito nuevo que nombró Trypanosoma cruzi. Luego encontró este mismo parásito en el intestino de un insecto triatomino, indicando que los insectos eran el vector, o por lo menos un reservorio del parásito. Cuando inoculó los animales de laboratorio con el parásito, aparecieron las lesiones características de la enfermedad que había hecho estragos en la región. Determinó que el Trypanosoma cruzi era el agente causal y nombró esta enfermedad la enfermedad de Chagas (Náquira y Cabrera 494-495). Aunque solo se descubrió hace 114 años, esta enfermedad ha existido durante al menos nueve mil años según los segmentos del ADN de Trypanosoma cruzi en las momias de la cultura chinchorro que vivía entre el norte de Chile y el sur de Perú (Fornaciari et al. 128-129).
A pesar de los descubrimientos de Chagas sobre el agente causal de la enfermedad y su presencia en los intestinos de los insectos triatominos, todavía había confusión e ideas contradictorias sobre la enfermedad. Por ejemplo, en Argentina se pensaba que los insectos triatominos (llamados “vinchucas” en Argentina) no causaban la enfermedad. Específicamente, el Instituto Bacteriológico de Argentina, la principal autoridad de enfermedades infecciosas en Argentina durante la época, declaró que el T. cruzi siempre causaba el bocio. Por lo tanto, los casos de infección por picadura de vinchucas que no resultaban en el bocio se consideraban una evidencia de que las vinchucas en Argentina no causaban la misma enfermedad que Chagas había descubierto en Brasil (Zabala 59-60). En realidad, la infección provocada por T. cruzi no siempre causa el bocio, así que este razonamiento fue erróneo. Los casos sin bocio muy bien pudieron haber sido la misma enfermedad aunque los síntomas diferían de los casos confirmados con bocio. No obstante, nunca es fácil convencer al público general sobre los hechos relacionados con las enfermedades, como hemos visto en los últimos años. Desafortunadamente, la lucha contra la desinformación e ignorancia retrasa el progreso para mejorar la salud de todo el mundo.
Como resultado de las confusiones alrededor del Chagas, la investigación se paró por más de una década entre 1916 y 1926. Entonces la enfermedad comenzó a aparecer con frecuencia creciente, atrayendo la atención de investigadores de nuevo. En 1926, la Universidad de Buenos Aires creó un laboratorio para explorar y estudiar las enfermedades comunes en Argentina llamado Misión de Estudios de Patología Regional Argentina (Zabala 60), cuyo director, Charles Nicolle, fue un científico consumado que ganó el premio Nobel por su trabajo sobre el tifus en 1928 (“Charles Nicolle (1866-1936)”). Un alumno de Nicolle que trabajaba en el laboratorio, Salvador Mazza, desarrolló un programa que buscaba investigar y curar enfermedades poco estudiadas del país, siendo una de ellas el Chagas (Zabala 60-61).
En 1930, Salvador Mazza descubrió los primeros casos confirmados del Chagas en animales. Inicialmente se encontró en perros, armadillos, murciélagos y comadrejas. Durante la década de 1930, a pesar de la resistencia social, científica y religiosa, Mazza detectó más de 1,200 casos confirmados del Chagas. Sus esfuerzos incansables establecieron la enfermedad como una grave amenaza en Argentina, logrando que los científicos y el gobierno alcanzaran más control sobre la enfermedad (Zabala 60-62). No hay duda de que sus descubrimientos cambiaron totalmente la dirección del entendimiento del mal de Chagas y los esfuerzos contra la enfermedad, ya que se pasó de una etapa de estancamiento e ignorancia a otra de progreso, conocimiento e incluso mejor control.
Carlos Chagas murió a los 55 años en 1934 por complicaciones cardiacas recordativas de las que estudiaba en los casos de la enfermedad que descubrió (“Muere un gran hombre de ciencia”). Desafortunadamente, luego en 1946, Mazza sufrió el mismo destino a los sesenta años, muriendo de una enfermedad cardiaca, más probablemente también provocada por la enfermedad a la que dedicó su vida a estudiar. Los dos investigadores contribuyeron tanto al estudio de la enfermedad de Chagas que en Argentina la enfermedad se llamó la enfermedad de Chagas-Mazza para reconocer las contribuciones de los dos (Zabala 62-63). Ante la adversidad y la duda, los dos hombres persistieron incansablemente, y sus esfuerzos han prevenido la pérdida de vidas incontables. Los esfuerzos continuados hasta una cura honran sus sacrificios.

Figure 2. Un insecto triatomino, el vector del parásito Trypanosoma cruzi, el agente causal del mal de Chagas. Photo by Heigen Villacarlos via Wikimedia Commons.
La propagación del parásito
Hoy en día, hay muy poco debate sobre si el mal de Chagas se transmite a través de los insectos triatominos que llevan el parásito en sus estómagos. Cuando los insectos defecan, pueden causar infección si sus heces entran en contacto con la persona a través de una herida cutánea. Frecuentemente, esto sucede cuando los insectos pican a las personas y las personas empujan las heces dentro de la picadura por accidente cuando la rascan. A veces la picadura se hincha cuando se infecta, pero no siempre. Además, si una persona toca las heces y luego se toca los ojos, se puede infectar. En este caso, es común que se les hinchen los párpados, un fenómeno que se llama “el signo de Romaña” (“CDC – Chagas Disease”). Este signo ha sido entendido desde los días de Mazza, siendo la primera persona que oficialmente lo reconoció (Zabala 62). En lugares donde los insectos triatominos son ubicuos, es efectivamente inevitable que ocurra la infección.
Es posible que algunas personas se infecten indirectamente ingiriendo comida contaminada por las heces de un insecto infectado. Asimismo, el parásito se puede transmitir a través de transfusiones sanguíneas, trasplantes de órganos o congénitamente, de madre a hijo (“La enfermedad de Chagas”). Se estima que un 5% de las madres embarazadas infectadas con el Chagas transmiten el parásito a su hijo. Si la madre lleva el parásito en niveles más altos, es más probable que lo transmita congénitamente (Howard et al. 22). Es esencial, entonces, considerar la sanidad general y la atención para las mujeres embarazadas en lugares donde el Chagas es común.
Ya que el Chagas se transmite a través (del vector) de los insectos triatominos, una mala higiene sirve como caldo de cultivo para la enfermedad. Las áreas rurales suelen tener peor higiene, así que el Chagas hace estragos allí de forma desproporcionada (“La enfermedad de Chagas”). Desafortunadamente, debido a que es más común en áreas con menos recursos económicos, se considera una enfermedad de pobres. Por eso, no recibe la misma atención de las compañías farmacéuticas y los gobiernos como las enfermedades que podrían traer más lucro, como pueden ser el COVID-19, el VIH o la malaria. Mientras la gente no presta atención, el Chagas sigue matando a sus víctimas en silencio a lo largo de varias décadas.
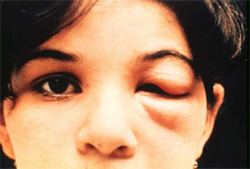
Figure 3. El signo de Romaña, un signo común que puede indicar infección por T. cruzi a través del ojo. Photo by World Health Organization via Centers for Disease Control and Prevention.
Los efectos de la enfermedad
En América Central, América del Sur y partes del sur de Estados Unidos, el Chagas constituye un parásito endémico, y en cualquier momento dado, hay seis a ocho millones de personas infectadas. Además, mata a más de diez mil personas cada año (“La enfermedad de Chagas”). Considerando el número de víctimas, la atención médica necesitada y la productividad perdida como resultado de la enfermedad, el gasto económico anual es siete mil millones de dólares (Beaumier et al. 2996). Sin embargo, los poderes existentes no priorizan prevenir, tratar y curar el Chagas y el costo de nuestra sociedad es incalculable.
La patología del Chagas se divide en dos fases, que son la aguda y la crónica. La fase aguda dura semanas o meses después de la infección inicial. Usualmente carece de síntomas, o solo tiene síntomas leves. Al contrario, en casos sintomáticos, un paciente padece una miríada de síntomas, incluyendo la hinchazón en el lugar de infección inicial, erupción, fiebre, fatiga y síntomas gastrointestinales. A veces se desarrolla inflamación grave del cerebro o del corazón (“Enfermedad de Chagas – Síntomas y causas”). La infección durante la fase aguda se puede detectar microscópicamente por niveles altos de parasitemia, o sea, parásitos en la sangre. Tras cuatro a ocho semanas, los niveles de la parasitemia disminuyen hasta que no se pueden detectar. No obstante, los parásitos persisten dentro de las células del huésped durante la próxima fase de la enfermedad, la fase crónica (Bern 2528). La educación sobre los síntomas de la fase aguda y las pruebas de vigilancia son muy importantes y pueden salvar vidas porque el tratamiento es más eficaz durante esta fase.
La fase crónica persiste después de la infección inicial, con niveles de parásitos más bajos. Podría carecer de síntomas y evitar la detección durante décadas después de la infección inicial o incluso puede no detectarse nunca (“Enfermedad de Chagas – Síntomas y causas”). Los casos que quedan asintomáticos después de recuperarse de la infección inicial se llaman “indeterminados” porque todavía quedan parásitos en las células del infectado, pero no se sabe si causarán síntomas en el futuro. Mientras tanto, los casos crónicos que presentan síntomas se llaman “determinados” porque han llegado al punto que la infección se presenta de nuevo. Se estima que un 30% de los casos crónicos progresarán a ser determinados (Apt B et al. 195).
Los síntomas de la fase crónica determinada incluyen “latidos irregulares del corazón, insuficiencia cardíaca, paro cardíaco repentino, dificultad para tragar por el agrandamiento del esófago, dolor estomacal o estreñimiento por el agrandamiento del colon” (“Enfermedad de Chagas – Síntomas y causas”). Casi todos los casos determinados presentan síntomas cardiacos que se llaman la cardiomiopatía chagásica, mientras que un tercio presentan síntomas digestivos (“La enfermedad de Chagas”). El parásito causa estos síntomas porque vive en los tejidos corporales de la persona que infecta, haciendo daño poco a poco a lo largo de varios años. Eventualmente, este daño puede causar fallos orgánicos, lo que resulta en la muerte del 7.9% de las personas que desarrollan la cardiomiopatía chagásica (Chadalawada et al. 5466), es decir, aproximadamente el 2.3% de todos los infectados. Para ponerlo en perspectiva, el COVID-19 tiene una tasa de mortalidad menor del 1% (“COVID – Coronavirus Statistics – Worldometer”).
Sorprendentemente, el 70% de las personas infectadas no saben que lo están (“El 70% de las personas con Chagas”). Para diagnosticar el Chagas, se usan pruebas parasitológicas que detectan parásitos vivos en la sangre durante la fase aguda cuando un paciente presenta síntomas por primera vez. En casos crónicos con niveles de parásitos demasiado bajos para detectar directamente, las pruebas serológicas que son más sensibles y que detectan anticuerpos contra los parásitos revelan si una persona está infectada (“Secretaría de salud – Enfermedad de Chagas”). Desafortunadamente, ambas pruebas son prohibitivamente caras (Hotez et al. 2). Por eso, las personas pobres no pueden acceder a ellas, y especialmente no pueden justificar pagarlas si carecen de síntomas, lo cual frecuentemente es el caso. Entonces el Chagas escapa la detección temprana en la mayoría de los casos, especialmente entre los pobres, y sigue contagiando a más personas. Cómo el VIH, el COVID-19 y la malaria, es una enfermedad potencialmente fatal que se contagia sin control, pero no recibe la misma atención ni el mismo financiamiento.
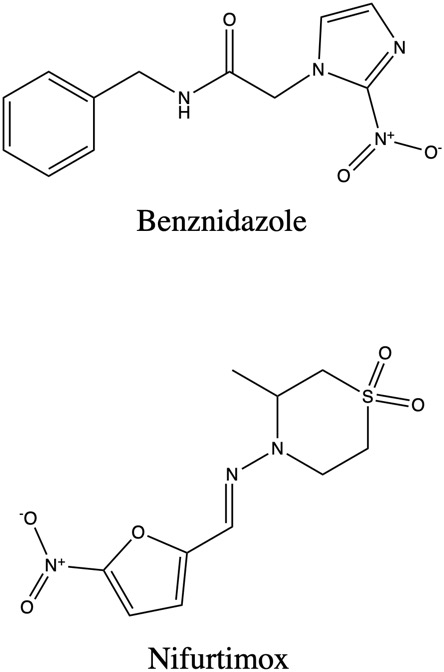
Figure 4. El Benznidazol y el Nifurtimox, los dos tratamientos quimioterapéuticos más comunes contra la enfermedad de Chagas. Photo created by author using ChemDraw 20.1.
Tratamientos actuales, lo bueno y lo malo
En este momento, el Chagas se trata por medicamentos anti-tripanosomas, sobre todo el Benznidazol y el Nifurtimox (“Enfermedad de Chagas – Enfermedades infecciosas”). El desarrollo de tratamientos comenzó al descubrir la enfermedad, pero sin éxito sustancial hasta 1966 cuando se creó el Benznidazol. El Benznidazol forma un enlace covalente con intermedios de nitroreducción esenciales al metabolismo de los parásitos, lo cual los mata (Docampo 6). El Nifurtimox, que se desarrolló en los años 1970, produce metabolitos de oxígeno reducidos. En comparación con los humanos, los parásitos tienen menos capacidad de desintoxicar estos metabolitos que las células humanas, matando a los parásitos sin causar demasiado daño a los humanos (Bern 2528).
El objetivo principal de los medicamentos es prevenir la progresión hacia el daño de los tejidos corporales durante la fase crónica determinada, lo cual causa complicaciones y muerte. Aunque se ha demostrado que estos tratamientos son eficaces hasta cierto punto, sus mecanismos de función bioquímica conllevan efectos secundarios negativos para los humanos, lo cual previene que se usen en todos casos (“CDC – Chagas Disease”). En realidad, los medicamentos antiparasitarios en general tienen efectos secundarios notoriamente malos. Por ejemplo, los tratamientos contra la malaria, otra enfermedad causada por un parásito, también provocan efectos secundarios perjudiciales a los humanos. Las células de parásitos tienen más en común con las células de los humanos, como la presencia de un núcleo y la falta de una pared celular, en comparación con otros patógenos como las bacterias que tienen una pared celular pero faltan un núcleo. Por esta razón, los mecanismos que se aprovechan de las características vulnerables de las células parasitarias pueden también ser dañinos para el humano.
En el caso de los tratamientos contra el Chagas, el Benznidazol puede causar la dermatitis, la neuropatía, la anorexia y el insomnio (“Tratamiento antiparasitario”). Por ejemplo, un estudio en España de la Unidad Regional de Medicina Tropical determinó que un 40.2% de las personas que toman el Benznidazol tienen efectos adversos. Específicamente, un 30.2% sufren efectos de la piel y un 9.1% de intolerancia digestiva, entre otros (Fernández et al. 123-124). Igualmente, el Nifurtimox causa síntomas neurológicos y gastrointestinales (“Tratamiento antiparasitario”). En cierta medida, estos efectos secundarios son inevitables, pero con estos medicamentos son bastante extensos. Por lo tanto, se justificaría la investigación e inversión en buscar tratamientos alternativos con menos efectos secundarios.
Otro problema enorme es que los dos tratamientos están contraindicados con el embarazo. Por eso, las mujeres embarazadas no pueden tomar estos medicamentos porque pueden dañar al feto. En este caso, la única forma de tratamiento es intentar reducir los síntomas cardíacos (“Embarazo y Chagas – WikiCardio”). Durante el embarazo, los parásitos dañan a la mujer, y es posible que sufra alguna forma del Chagas crónico más tarde. Además, como se ha mencionado antes, estar infectado con el parásito aumenta el riesgo de transmitirlo al hijo (“Embarazo y Chagas – COALICIÓN CHAGAS”).
La mejor manera de medir la eficacia de estos medicamentos es usar las pruebas serológicas que detectan anticuerpos contra los parásitos y son más sensibles que las pruebas parasitológicas, que solo pueden detectar los parásitos directamente (“Secretaría de salud – Enfermedad de Chagas”). Si una persona anteriormente infectada se trata y entonces la prueba serológica no detecta los anticuerpos contra el parásito, es probable que el parásito ya no esté y el medicamento haya funcionado. No obstante, en niveles muy bajos, el parásito todavía puede evitar la detección de incluso estas pruebas (Forsyth et al. 1056). En consecuencia, medir con certeza la eficacia de los medicamentos es difícil porque no siempre está claro si eliminaron totalmente el parásito que puede persistir en niveles indetectables.
A pesar de los efectos secundarios y la dificultades de medir la eficacia de los medicamentos, es obvio que los pacientes que reciben tratamiento más temprano obtienen mejores resultados en prevenir la progresión hacia la fase crónica determinada. Además, los medicamentos son más eficaces en pacientes más jóvenes y que han estado infectados por menos tiempo. En los casos en los que el Benznidazol o el Nifurtimox se administra temprano en el desarrollo de la infección, los dos tratamientos son casi un 100% eficaces en los recién nacidos que se infectan congénitamente, y más de un 60% eficaces en los casos agudos generales. En cuanto a los casos crónicos indeterminados, la eficacia de los tratamientos no se ha medido con certeza por las dificultades de detectar el patógeno antes y después del tratamiento, pero los resultados sugieren que los medicamentos ayudan a prevenir la progresión a síntomas crónicos (Forsyth et al. 1056). Por último, en los casos que nunca han mostrado síntomas, el tratamiento no es común por los efectos secundarios.
Ahora mismo, estos dos medicamentos son la única opción viable para tratar el mal de Chagas. Si bien el tratamiento se indica para las etapas tempranas de los casos determinados, la eficacia disminuye con el tiempo (Forsyth et al. 1056-1057). Desafortunadamente, por el costo de los medicamentos, la dificultad de identificar casos de la enfermedad en primer lugar y los casos por los que no es ideal usar los medicamentos, como el embarazo o las personas que teman los efectos secundarios, solamente un 1% de las personas infectadas reciben tratamiento cada año (“El 70% de las personas con Chagas”). En el futuro cercano, hay que expandir las pruebas de vigilancia para identificar más casos, movilizarse para proporcionar los medicamentos a más personas y seguir buscando tratamientos alternativos con menos de estas limitaciones.
Figure 5. Las vacunas contra el Chagas podrían ser la opción más prometedora para controlarlo. Photo from Texas Heart Institute
Las vacunas del futuro
Los investigadores del Sabin Vaccine Institute, la Universidad de Baylor, otras universidades en el estado de Texas y varias universidades de Argentina, España y Brasil intentan crear varios tipos de vacunas para aliviar la carga del Chagas. En 2016, había dos perfiles de producto objetivo: una vacuna preventiva y una vacuna terapéutica. Una vacuna preventiva busca prevenir la infección y se administra a la población general, mientras que la vacuna terapéutica busca tratar y eliminar el parásito de las personas que están en la fase indeterminada crónica, o las etapas tempranas de la fase determinada crónica. Otra opción es combinar la vacuna terapéutica con los medicamentos quimioterapéuticos que ya existen. Se espera que la eficacia sea aún más alta si se usan en conjunto (Beaumier et al. 2998).
Una limitación de la vacuna preventiva es que no se puede romper la cadena de transmisión totalmente en el caso del Chagas. Es decir, la vacuna preventiva impide la enfermedad en las personas que reciben la vacuna, pero los insectos triatominos siguen sirviendo como reservorios del parásito. Por eso, las personas que no han recibido la vacuna preventiva todavía serán vulnerables.
Al contrario, con las enfermedades de las que los humanos son los únicos o principales vectores, como el COVID-19, el VIH y la gripe, se puede alcanzar una inmunidad colectiva sin vacunar a todo el mundo (“Herd Immunity – an overview”). Por ejemplo, los casos más famosos de este fenómeno serían la viruela, que se erradicó al vacunar a aproximadamente un 80% de la población humana mundial (“Smallpox Vaccines”), y la polio, que casi se ha erradicado al vacunar a aproximadamente un 84% de la población mundial (“Immunization Coverage”). Lamentablemente, con una vacuna preventiva contra el Chagas, habría que inocular a cada persona en la sociedad para erradicarlo, lo cual no es realista. Asimismo, los esfuerzos de crear vacunas contra otras enfermedades con reservorios animales como la malaria enfrentan esta complicación. Sin embargo, proteger a las personas que reciben la vacuna preventiva sería un buen paso hacia el control del Chagas.
Los análisis de rentabilidad (considerando costo de fabricación y distribución frente al dinero ahorrado en atención médica y productividad) indican que la opción más prometedora es la vacuna terapéutica. Solo se administraría a las personas infectadas y ofrecería protección aunque ya estuvieran infectadas, al menos en teoría (Beaumier et al. 2998). No obstante, el problema con esta opción es que todavía sería difícil de saber con seguridad si una persona está infectada, y consecuentemente si debe recibir esta vacuna, por lo que una vacuna terapéutica tendría que ir acompañada de mejores esfuerzos de pruebas de vigilancia para alcanzar su eficacia plena.
A lo largo del desarrollo de las vacunas, los resultados han sido prometedores. Sin embargo, el progreso es lento. Entre 2007 y 2013, solamente se otorgaron seis millones de dólares en fondos a los esfuerzos. La mayoría de este dinero vino de los principales patrocinadores del sector público como el Ministerio Argentino de la Innovación de Ciencia, Tecnología e Innovación, el Instituto Pasteur, el Ministerio Federal Alemán de Educación e Investigación (BMBF) y los Institutos Nacionales de Salud de Estados Unidos (NIH) (Beaumier et al. 2998-2999). Al mismo tiempo, el gasto económico del Chagas es de más de siete mil millones de dólares cada año a la economía mundial en atención médica y productividad perdida. Las vacunas podrían prevenir o curar una enfermedad que cada año mata a diez mil personas y cuesta a la sociedad muchas veces más de lo que costaría desarrollar las vacunas. Es para el mejor interés de todo el mundo que los gobiernos mundiales, las compañías farmacéuticas y otras organizaciones filantrópicas, ya sean públicas o privadas, inviertan en el futuro de la salud humana contribuyendo recursos a los esfuerzos de desarrollar una vacuna contra el Chagas.
Bibliografía
Apt B, Werner, et al. “Guías clínicas de la enfermedad de Chagas: Parte II. Enfermedad de Chagas en el adulto, la infancia y adolescencia”. Revista chilena de infectología, vol. 25, núm. 3, junio de 2008, pp. 194–99. SciELO, https://doi.org/10.4067/S0716-10182008000300009.
Beaumier, Coreen M., et al. “Status of Vaccine Research and Development of Vaccines for Chagas Disease”. Vaccine, vol. 34, núm. 26, junio de 2016, pp. 2996–3000. DOI.org (Crossref), https://doi.org/10.1016/j.vaccine.2016.03.074.
Bern, Caryn. “Antitrypanosomal Therapy for Chronic Chagas’ Disease”. New England Journal of Medicine, vol. 364, núm. 26, junio de 2011, pp. 2527–34. Taylor and Francis+NEJM, https://doi.org/10.1056/NEJMct1014204.
“CDC – Chagas Disease”. cdc.gov, el 12 de abril de 2019, https://www.cdc.gov/parasites/chagas/es/index.html.
Chadalawada, Sindhu, et al. “Mortality Risk in Chronic Chagas Cardiomyopathy: A Systematic Review and Meta-Analysis”. ESC Heart Failure, vol. 8, núm. 6, diciembre de 2021, pp. 5466–81. PubMed, https://doi.org/10.1002/ehf2.13648.
“Charles Nicolle (1866-1936)”. Institut Pasteur, el 15 de noviembre de 2016, https://www.pasteur.fr/en/institut-pasteur/history/charles-nicolle-1866-1936.
“COVID – Coronavirus Statistics”. Worldometer, https://www.worldometers.info/coronavirus/. Consultado el 28 de septiembre de 2023.
Docampo, Roberto. “Sensitivity of Parasites to Free Radical Damage by Antiparasitic Drugs”. Chemico-Biological Interactions, vol. 73, núm. 1, enero de 1990, pp. 1–27. ScienceDirect, https://doi.org/10.1016/0009-2797(90)90106-W.
Dumonteil, Eric, et al. “Accelerating the development of a therapeutic vaccine for human Chagas disease: rationale and prospects”. Expert Review of Vaccines, vol. 11, núm. 9, septiembre de 2012, pp. 1043–55. Taylor and Francis+NEJM, https://doi.org/10.1586/erv.12.85.
“El 70% de las personas con Chagas no saben que están infectadas – OPS/OMS” Organización Panamericana de la Salud, https://www.paho.org/es/noticias/13-4-2021-70-personas-con-chagas-no-saben-que-estan-infectadas. Consultado el 18 de noviembre de 2022.
“Embarazo y Chagas – COALICIÓN CHAGAS”. InfoChagas, https://www.infochagas.org/embarazo-y-chagas. Consultado el 15 de diciembre de 2022.
“Embarazo y Chagas”.WikiCardio, http://www.wikicardio.org.ar/wiki/Embarazo_y_Chagas. Consultado el 15 de diciembre de 2022.
“Enfermedad de Chagas – Enfermedades infecciosas”. Manual Merck versión para profesionales, https://www.merckmanuals.com/es-us/professional/enfermedades-infecciosas/protozoos-extraintestinales/enfermedad-de-chagas. Consultado el 20 de noviembre de 2022.
“Enfermedad de Chagas – Síntomas y causas”. Mayo Clinic, https://www.mayoclinic.org/es-es/diseases-conditions/chagas-disease/symptoms-causes/syc-20356212. Consultado el 18 de noviembre de 2022.
Fernández, Bartolomé Carrilero, et al. “Efectos secundarios del tratamiento con benznidazol en una cohorte de pacientes con enfermedad de Chagas en un país no endémico”. Revista Española de Quimioterapia, vol. 24, núm. 3, 2011, pp. 123–26.
Fornaciari, Gino, et al. “Chagas’ Disease in Peruvian Inca Mummy”. The Lancet, vol. 339, núm. 8785, enero de 1992, pp. 128–29. ScienceDirect, https://doi.org/10.1016/0140-6736(92)91043-8.
Forsyth, Colin J., et al. “Safety Profile of Nifurtimox for Treatment of Chagas Disease in the United States”. Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America, vol. 63, núm. 8, octubre de 2016, pp. 1056–62. PubMed Central, https://doi.org/10.1093/cid/ciw477.
“Herd Immunity – an overview”. ScienceDirect Topics, https://www.sciencedirect.com/topics/immunology-and-microbiology/herd-immunity. Consultado el 28 de septiembre de 2023.
Hotez, Peter J., et al. “An Unfolding Tragedy of Chagas Disease in North America”. PLOS Neglected Tropical Diseases, vol. 7, núm. 10, octubre de 2013, p. 1-4 PLoS Journals, https://doi.org/10.1371/journal.pntd.0002300.
Howard, Ej, et al. “Frequency of the Congenital Transmission of Trypanosoma Cruzi: A Systematic Review and Meta-Analysis”. BJOG: An International Journal of Obstetrics & Gynaecology, vol. 121, núm. 1, 2014, pp. 22–33. Wiley Online Library, https://doi.org/10.1111/1471-0528.12396.
“Immunization Coverage”. who.int, https://www.who.int/news-room/fact-sheets/detail/immunization-coverage. Consultado el 28 de septiembre de 2023.
“La enfermedad de Chagas (tripanosomiasis americana)”. https://www.who.int/es/news-room/fact-sheets/detail/chagas-disease-(american-trypanosomiasis). Consultado el 18 de noviembre de 2022.
Lewinsohn, Rachel. “Prophet in His Own Country: Carlos Chagas and the Nobel Prize”. Perspectives in Biology and Medicine, vol. 46, núm. 4, 2003, pp. 532–49. PubMed, https://doi.org/10.1353/pbm.2003.0078.
“Muere un gran hombre de ciencia”. Cubadebate, el 9 de noviembre de 2017, http://www.cubadebate.cu/noticias/2017/11/09/muere-un-gran-hombre-de-ciencia/.
Náquira, César, y Rufino Cabrera. “Breve Reseña Histórica De La Enfermedad De Chagas, a Cien Años De Su Descubrimiento Y Situación Actual En El Perú.” Revista Peruana de Medicina Experimental y Salud Pública, vol. 26, núm. 4, octubre de 2009, pp. 494–504.
“Secretaría de salud – Enfermedad de Chagas”. gob.mx, http://www.gob.mx/salud/acciones-y-programas/enfermedad-de-chagas. Consultado el 18 de noviembre de 2022.
“Smallpox Vaccines”. who.int, https://www.who.int/news-room/feature-stories/detail/smallpox-vaccines. Consultado el 28 de septiembre de 2023.
“Tratamiento antiparasitario”. CDC.gov, el 9 de octubre de 2019, https://www.cdc.gov/parasites/chagas/es/hcp/tratamiento.html.
Zabala, Juan Pablo. “Historia de la enfermedad de Chagas en Argentina: evolución conceptual, institucional y política”. História, Ciências, Saúde-Manguinhos, vol. 16, julio de 2009, pp. 57–74. SciELO, https://doi.org/10.1590/S0104-59702009000500004.
Acknowledgements
I would like to thank my research mentor, Dr. Magdalena Matuskova, for her help throughout the process of writing and revising this essay. She has taught me an incredible amount of new Spanish, been very patient with me, and made many helpful suggestions to improve my essay during our weekly meetings.
Citation style used: MLA